Glejak wielopostaciowy – leczenie, rokowanie
Glejak wielopostaciowy (glioblastoma) to złośliwy guz mózgu o złym rokowaniu. Poznaj formy leczenia glejaka wielopostaciowego i informacje o złośliwym raku mózgu:
Naciekający charakter glejaka wielopostaciowego sprawia, że jest on niezwykle trudny do usunięcia w całości. Pomimo chirurgicznej resekcji, naświetlań i agresywnej chemioterapii szybko powraca, rośnie i stopniowo upośledza pracę kolejnych fragmentów mózgu. Poniższy artykuł zawiera aktualne informacje dotyczące możliwości terapii złośliwego glejaka wielopostaciowego G IV.
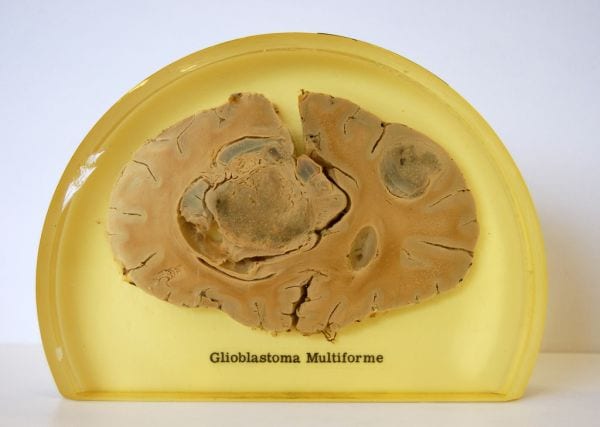
Glejak wielopostaciowy (glioblastoma GBM) to bogatokomórkowy nowotwór z przeważającym różnicowaniem astrocytarnym, charakteryzujący się atypią i pleomorfizmem jąder komórkowych, aktywnością mitotyczną, a także obecnością ognisk martwicy tkankowej i rozrostem naczyń. Wyodrębnia się dwa histologiczne podtypy glejaka wielopostaciowego: glioblastoma olbrzymiokomórkowy i glejakomięsak (gliosarcoma)
PRZYCZYNY POWSTAWANIA GLEJAKA WIELOPOSTACIOWEGO
Etiologia zdecydowanej większości przypadków tych nowotworów jest nieznana. W niewielkiej ilości przypadków glejak wielopostaciowy może rozwijać się w następstwie radioterapii litych nowotworów głowy i szyi, a także po profilaktycznym napromienianiu cewy nerwowej w przebiegu rozrostów układowych (np. u dzieci z ostrą białaczką limfoblastyczną). Glejak wielopostaciowy był opisywany u chorych z dziedziczną skłonnością do rozwoju nowotworów – mutacje konstytutywne genu TP53, zespół Turcota typu 1.
JAK WYGLĄDA GLEJAK WIELOPOSTACIOWY (OBRAZ MIKROSKOPOWY GLEJAKA)
Charakterystyczną cechą glioblastoma jest różnorodność utkania histologicznego i jego składu komórkowego. Istotnym kryterium diagnostycznym dla rozpoznania glejaka wielopostaciowego jest obecność obszarów martwicy tkankowej i/lub proliferacji mikronaczyniowych. Te ostatnie, rozrastając się, tworzą często sieć naczyć przypominających kłębuszki czy girlandy.
Pomimo dość dobrego makroskopowego odgraniczenia od tkanek otaczających, komórki glejaka wielopostaciowego głęboko naciekają mózgowie. W niektórych przypadkach rozległy naciek wzdłuż naturalnych struktur mózgowia daje klinicznie obraz glejaka w kształcie motyla (butterfly glioma) – jest to efekt szerzenia się komórek raka do przeciwległej półkuli mózgu. Odległe naciekanie guza poza obszar wzmocnienia kontrastowego widocznego na badaniach obrazowych umożliwia komórkom glejaka wielopostaciowego przetrwanie napromieniania i stanowi przyczynę szybkiego nawrotu choroby.
GLEJAK WIELOPOSTACIOWY – CHEMIOTERAPIA
Chemioterapia glejaka wielopostaciowego może być stosowana zarówno w celu zwiększenia skuteczności leczenia miejscowego (operacja chirurgiczna i/lub radioterapia guza mózgu), jak i w ramach postępowania paliatywnego u chorych w stadium nawrotu choroby.
Aktualnym standardem leczenia jest kojarzenie chemioterapii wraz z napromienianiem w ramach postępowania pooperacyjnego oraz u osób niepoddawanych resekcji guza mózgu. Wiąże się to z wysokim ryzykiem naciekania miejscowego i rozsiewy wewnątrzmózgowego komórek rakotwórczych, a także z powstawaniem tzw promieniooporności guza. Glejak wielopostaciowy może zawierać obszary o gorszym unaczynieniu, co dodatkowo nasila oporność na działanie radioterapii. Zastosowanie substancji o działaniu promieniouczulającym może zwiększyć skuteczność napromieniania. W 2002 roku opublikowane zostały wyniki metaanalizy grupy GMT, oparte na systematycznym przeglądzie wszystkich dotychczasowych badań randomizowanych, w których u chorych po leczeniu chirurgicznym stosowano radioterapię w skojarzeniu z chemioterapią lub samą radioterapię. Wykazano znamienne wydłużenie przeżycia chorych leczonych z udziałem chemioterapii.
W 2005 roku opublikowane zostały wyniki badania prowadzonego we współpracy z EORTC i NCIC, w którym porównano pooperacyjną radioterapię uzupełnioną temodalem (temozolomid) z wyłącznym napromienianiem. Chorzy z rozpoznaniem glioblastoma byli napromieniani do dawki 60 Gy albo poddawani radioterapii z jednoczesnym stosowaniem temodalu (temozolomid) w sposób ciągły w dobowej dawce 75 mg/m2 ciała oraz kontynuacją leczenia temodalem po zakończeniu radioterapii (cześć cykli z podawaniem leku przez pięć dni w dobowej dawce 200 mg/m2 co 28 dni). W grupie otrzymującej leczenie skojarzone uzyskano znamienne lepsze wyniki (dłuższy czas przeżycia wolnego od progresji guza) niż u chorych poddanych samej radioterapii.
Chemioradioterapia z użyciem temozolomidu pozwala wydłużyć czas przeżycia, zwłaszcza chorych z metylacją promotora genu odpowiedzialnego za syntezę enzymu naprawczego MGMT.
Dodatkowo prowadzona analiza zależności między wynikami leczenia a metylacją genu MGMT, który koduje białko odpowiedzialne za naprawę uszkodzeń wywołanych przez temozolomid i pochodne nitrozomocznika wykazała znacznie większe korzyści z przyjmowania chemioterapii u chorych z obecnością w kodzie genetycznym wspomnianej nieprawidłowości.
Wartość radiochemioterapii z temozolomidem w odniesieniu do innych złośliwych glejaków nie została dotychczas udowodniona.
WZNOWA GLEJAKA WIELOPOSTACIOWEGO – CHEMIOTERAPIA W STADIUM NAWROTU RAKA MÓZGU
Skuteczność pochodnych nitrozomocznika stanowi punkt odniesienia w porównaniu wartości chemioterapii paliatywnej stosowanej u chorych z rozpoznaniem złośliwych glejaków. Obiektywne odpowiedzi po zaaplikowaniu lomustyny bądź karmustyny oraz prokarbazyny obserwuje się u 20-30% chorych, przy czym najskuteczniejsza jest karmustyna. Schematy wielolekowe nie prowadzą do lepszych wyników niż monoterapia (podawanie jednego leku).
Postęp w zakresie chemioterapii paliatywnej wiąże się z wprowadzeniem Temodalu (temozolomid). W badaniach I i II fazy obserwowano obiektywne odpowiedzi i 20-35% chorych przy medianie czasu wolnego od progresji wynoszącej 20-25 tygodni. Wskazano, że dobry profil tolerancji leku ma korzystny wpływ na wskaźniki jakości życia.
Temodal (temozolomid) stanowi obecnie najbardziej wartościową opcję w postępowaniu paliatywnym wobec chorych na glejaka wielopostaciowego w stadium nawrotu choroby. W przypadku wcześniejszego stosowania leku w skojarzeniu z radioterapią zaleca się użycie pochodnych nitrozomocznika. Nie ma dowodów, które ostatecznie przesądzają o wyższości chemioterapii wielolekowej. Decyzja o zastosowaniu chemioterapii powinna być podejmowana po wykluczeniu możliwości ratunkowego leczenia chirurgicznego (reopoeracja) i radioterapii. Kwalifikacja do chemioterapii musi uwzględniać stan chorego i możliwość oceny odpowiedzi na terapię.
Pewną aktywność w nawrotowych glejakach złośliwych po wcześniejszej chemioterapii z temozolomidem wykazuje bewacyzumab (Avastin). Ze względu na brak wpływu na czas przeżycia całkowitego chorych nie został on jednak dotychczas zarejestrowany w Unii Europejskiej ( jest zarejestrowany w USA) i pozostaje metodą eksperymentalną. Inne leki o działaniu ukierunkowanym molekularnie (np. drobnocząsteczkowe inhibitory tyrozynowych kinaz) również są jedynie przedmiotem badań.
Perspektywy chemioterapii paliatywnej związane są z łącznym stosowaniem Temodalu w rytmie cotygodniowym w celu zmniejszenia MGMT w komórkach nowotworowych oraz łącznie z innymi lekami o działaniu cytotoksycznym lub ukierunkowanym molekularnie (terapia celowana molekularnie).
Obiecujące są próby kojarzenia leków cytotoksycznych i inhibitorów angiogenezy – np. w badaniu II fazy z irynotekanem i bewacyzumabem (AVASTIN) uzyskano 57% odpowiedzi; 6 miesięcy bez progresji, ogółem przeżyło odpowiednio 46% i 77% chorych. (Vredenburgh i wsp. 2007)
GLEJAK WIELOPOSTACIOWY – RADIOTERAPIA
Technika leczenia napromienianiem chorych z rozpoznaniem glejak wielopostaciowy jest analogiczna do stosowanej w gwiaździaku anaplastycznym. Ze względu na szybki wzrost nowotworu radioterapia powinna rozpocząć się możliwie szybko po leczeniu operacyjnym guza mózgu – zaraz po całkowitym zagojeniu rany pooperacyjnej. Zazwyczaj objętość napromienianych tkanek jest większa niż w wypadku gwiaździaka anaplastycznego, a w konsekwencji gorsza jest tolerancja leczenia. Rekomendowana dawka całkowita wynosi 60 Gy w 30 frakcjach po 2 Gy. Leczenie wyłącznie napromienianiem jest mało skuteczne. Pacjentów do radykalnej radioterapii należy więc rozważnie kwalifikować.
Najistotniejszymi czynnikami rakowniczymi są – wiek poniżej 50 lat, wysoki stopień sprawności ogólnej, dobra sprawność intelektualna oraz doszczętność operacji chirurgicznej.
Aktualnie, zgodnie z rekomendacjami onkologicznymi instytucji europejskich, kanadyjskich i amerykańskich, w pierwotnym leczeniu po cytoredukcyjnej operacji powinna być stosowana jednoczesna radiochemioterapia oparta na temodalu (temozolomid) 75 mg/m2 ciała dziennie w trakcie radioterapii oraz 150-200 mg/m2 ciała przez pięć dni, w sześciu kolejnych cyklach co 28 dni.
W kwalifikacji do tego leczenia skojarzonego należy uwzględniać możliwość przeprowadzenia 6-tygodniowego cyklu radioterapii do dawki 60 Gy.
Modyfikacje radioterapii guza mózgu mogą polegać na podwyższaniu dawki za pomocą radiochirurgii (radioterapia stereotaktyczna) lub brachyterapii.
W razie nawrotu u chorych niekwalifikujących się do ponownego leczenia chirurgicznego można rozważyć powtórną radioterapię.
JAK ODRÓŻNIĆ WZNOWĘ OD MARTWICY ? SPEKTROSKOPIA MRS
Glejak wielopostaciowy glioblastoma, bibliografia:
Pod. red. M. Krzakowski, Zalecenia postępowania diagnostyczno-terapeutycznego w nowotworach złośliwych – 2011 r., Tom I, Gdańsk 2011.
J. Meder, Aktualne zasady postępowania diagnostyczno-terapeutycznego w onkologii, Warszawa 2011.
P. P. Liberski, W. Kozubski, W. Biernat, R. Kordek, Nueroonkologia kliniczna, Lublin 2011.